昨天,中国核心学术期刊《中华流行病学杂志》刊登了题为“新型冠状病毒灭活疫苗(Vero细胞)大规模紧急使用安全性评价”的论文,发布基于国药集团中国生物北京制品研究所、武汉生物制品研究所新型冠状病毒灭活疫苗大规模紧急使用安全性评价。
研究表明,大规模新型冠病毒灭活疫苗(Vero细胞)进行紧急使用后,一般反应的发生率较低,未见严重不良反应,疫苗具有良好的安全性。
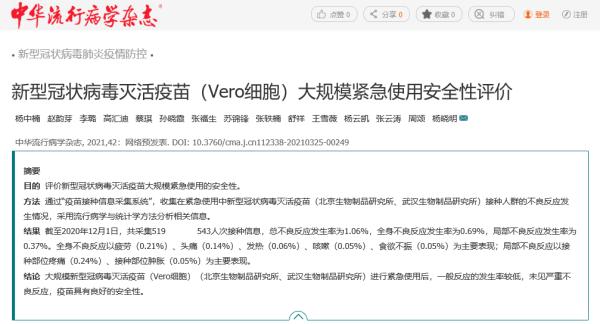
《中华流行病学杂志》论文发布截图。
国药集团中国生物北京制品研究所、武汉生物制品研究所新冠疫苗的Ⅰ/Ⅱ期临床阶段性研究结果均显示,新冠灭活疫苗接种后安全性良好,未见严重不良反应。2剂疫苗接种后28天,抗新冠病毒中和抗体4倍增长率接近100%。国务院联防联控机制分别于6月30日、7月23日将中国生物两款疫苗纳入国家新型冠状病毒疫苗紧急使用。
本研究利用中国生物自主开发的“疫苗接种信息采集系统”,对在该系统记录紧急使用的519543人次(截至2020年12月1日数据)的数据进行分析,研究对象主要包括:外交外派和中资企业出境的“一带一路”建设人员以及留学生;医疗机构的医护人员和疾控中心的一线工作人员;海关边检人员、口岸交通人员;涉及防控、治安,接触新冠病毒风险较高的各级政府部门、各企事业单位工作人员;城市一线生活服务保障人员等,初步评价新冠灭活疫苗在重点人群中紧急使用的安全性,为新冠灭活疫苗上市后的安全性评价提供重要依据。
未见严重不良反应,整体不良反应率低
基于监测到的519543人次接种信息,共监测不良反应信息5164条,北京制品研究所、武汉生物制品研究所生产的新冠灭活疫苗总不良反应发生率为1.06%,局部不良反应发生率为0.37%,全身不良反应发生率为0.69%。局部不良反应以接种部位疼痛、接种部位肿胀为主要表现,发生率分别为0.24%、0.05%,全身不良反应以疲劳、头痛、发热、咳嗽、食欲不振为主要表现,未见严重不良反应。
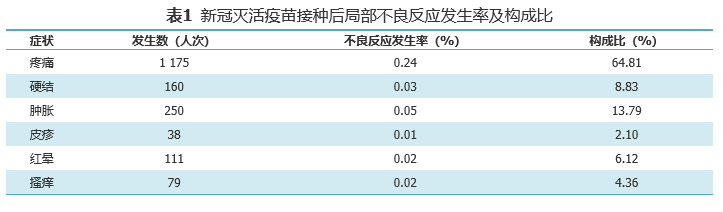
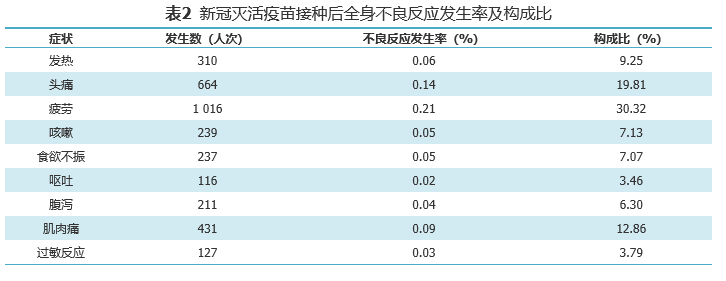
对比Ⅱ期临床试验,北京生物制品研究所生产的新冠灭活疫苗总体不良反应发生率为13%,武汉生物制品研究所生产的新冠灭活疫苗总体不良反应发生率为19%。
研究结果表明,中国生物新冠灭活疫苗不良反应率远低于Ⅱ期临床阶段性结果。
参考肠道病毒71型(EV71)灭活疫苗上市后大人群接种安全性分析结果,EV71灭活疫苗总不良反应发生率为1.079%~3.310%。甲型肝炎灭活疫苗在成人和儿童中的不良反应发生率分别为2.90%~35.56%。
疫苗接种后不良反应,一般3-4天即可缓解
根据“疫苗接种信息采集系统”收集信息统计,局部反应中接种部位疼痛主要发生在接种当天及接种后24小时内;接种部位硬结主要发生在接种后的1~4天内;接种部位肿胀、红晕、瘙痒及皮疹主要发生在接种后1周内。全身反应中接种后疲劳主要发生在接种当日及接种后的2天内;接种后头痛主要发生在0~3天内;肌肉痛主要发生在接种后0~3天内,以第1天发生最多;发热、咳嗽、食欲不振、腹泻及过敏主要发生在接种后的1周内。
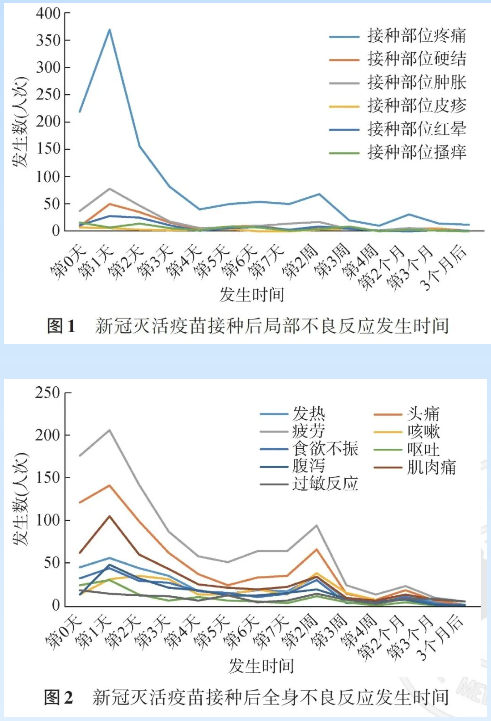
分析不同特征人群接种后不良反应,60岁以上人群不良反应率最低
按性别划分,“疫苗接种信息采集系统”累计记录男性接种者297996人次,男性接种后不良反应数据2149条;女性接种者190418人次,女性接种后不良反应数据3015条,女性的不良反应发生率(1.58%)高于男性(0.72%)。
按年龄划分,不良反应发生率最低为≥60岁人群,不良反应发生率为0.32%,其次是30~39岁人群,不良反应发生率为1.18%,12~18周岁人群不良反应发生率最高,为11.31%,以疲劳及接种部位疼痛为主。
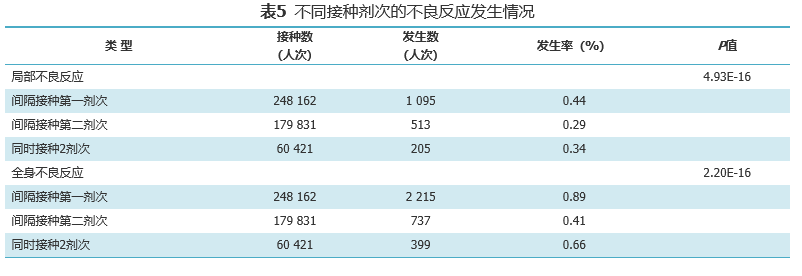
接种剂次差异上,第一剂次不良反应发生率高于第二剂次,同时2剂次的不良反应低于第一针。
不良反应情况与境外临床研究吻合
但发生率低于境外Ⅲ期临床试验中期分析结果
对比新冠灭活疫苗Ⅰ/Ⅱ期临床阶段性研究结果及海外Ⅲ期临床试验中期分析结果,接种后局部不良反应以接种部位疼痛、肿胀、红晕为主,全身不良反应以头痛、肌肉痛、腹泻(紧急使用未观察腹泻相关情况)、咳嗽、发热、乏力为主。本研究与境外Ⅲ期临床研究观察到的不良反应发生情况相吻合,但与境外Ⅲ期临床试验中期分析结果相比较,本研究不良反应发生率明显低于境外Ⅲ期临床试验中期分析结果。
综合来看,灭活疫苗作为所有研发技术路线中最传统、最经典的疫苗制备方式,甲型肝炎灭活疫苗、狂犬病疫苗和Sabin株脊髓灰质炎灭活疫苗等灭活疫苗在大规模人群中的应用,已经证明灭活疫苗具有良好的安全性和有效性。
在此次新冠肺炎疫情中,国药集团中国生物北京生物制品研究所与武汉生物制品研究所快速研发的两款新冠灭活疫苗,经Ⅰ期、Ⅱ期临床研究和大规模紧急使用证明,经大规模紧急使用接种和跟踪随访数据来看,表现出了良好的安全性,为疫苗附条件上市及上市后全国大规模人群广泛接种提供了有力支撑。
编辑: 陈捷纠错:171964650@qq.com